Kebanyakan basa adalah mineral yang bereaksi dengan asam untuk menghasilkan air dan garam. Basa dapat menetralisir asam melalui reaksi dengan ion hidrogen.
1. Identifikasi Sifat Asam, Basa, dan Garam
Di antara berbagai zat yang ada di alam semesta ini, asam, basa, dan garam merupakan zat yang paling penting yang diamati oleh para ahli kimia. Asam, basa, dan garam tersebar luas di alam semesta dan banyak digunakan baik di industri maupun rumah tangga.
Beberapa contoh zat asam yang banyak sekali berperan di bidang industri adalah asam sulfat (H2SO4) dan asam nitrat (HNO3). Selain itu, di rumah tangga kamu juga mengenal air soda yang merupakan asam karbonat (H2CO3). Di dalam perutmu juga terdapat asam yang disebut asam klorida (HCl). Jumlah asam klorida(HCl) dalam perutmu sedikit, tetapi asam klorida (HCl) ini merupakan asam yang sangat penting dalam proses pencernaan.
 |
| Jeruk nipis berasa masam karena mengandung asam sitrat. |
Nah, bagaimanakah sifat-sifat asam, basa, dan garam itu?
Sifat-sifat larutan asam adalah sebagai berikut.
a. Rasanya masam.
b. Menghantarkan arus listrik.
c. Jika dilarutkan akan melepaskan ion hidrogen (H+).
d. Mengubah lakmus biru menjadi merah.
e. Bersifat korosif terhadap logam.
 |
| Pasta gigi merupakan zat yang bersifat basa. |
keadaannya yang sangat pekat asam ini mampu melepuhkan kulit.
Sifat-sifat larutan basa adalah sebagai berikut.
a. Terasa licin jika terkena kulit.
b. Menghantarkan arus listrik.
c. Jika dilarutkan dalam air akan melepaskan ion hidroksida (OH¯).
d. Mengubah lakmus merah menjadi biru.
e. Menetralkan larutan asam.
 |
| Reaksi antara kalium hidroksida dan lemak membuat tangan kita terasa licin saat mencuci tangan dengan sabun. |
adalah amoniak (NH3).
Garam mempunyai sifat yang berbeda dengan asam dan basa. Sifat-sifat larutan garam adalah sebagai berikut.
a. Menghantarkan arus listrik.
b. Tidak mengubah warna kertas lakmus merah maupun biru.
Nah, untuk mengidentifikasi sifat larutan asam, basa, dan garam kamu dapat menggunakan indikator. Indikator ini dapat berubah warna ketika ditetesi zat yang bersifat asam atau basa. Indikator asam dan basa dapat berupa indikator buatan, seperti kertas lakmus, indikator universal, dan pH meter atau indikator alami, seperti bunga kembang sepatu, kubis ungu, dan kulit manggis.
a. Indikator Buatan
 |
| Kertas lakmus. |
Bagaimana kertas lakmus dapat digunakan untuk menentukan sifat asam, basa, dan garam? Kertas lakmus ada dua jenis yaitu kertas lakmus merah dan kertas lakmus biru. Kertas lakmus merah jika dicelupkan dalam larutan asam maka akan tetap berwarna merah begitu juga jika dicelupkan dalam larutan netral atau garam. Akan tetapi kertas lakmus merah akan berwarna biru jika dicelupkan dalam larutan basa. Adapun kertas lakmus biru akan berwarna merah jika celupkan dalam larutan asam, tetapi akan tetap berwarna biru jika dicelupkan dalam larutan basa atau netral.
Jadi larutan asam memerahkan kertas lakmus biru dan larutan basa membirukan kertas lakmus merah. Kertas
lakmus merah dan biru tidak akan berubah warna dalam larutan netral atau garam. Selain kertas lakmus kita juga dapat menggunakan indikator buatan yang lain seperti ditunjukkan pada Tabel 1.1 berikut.
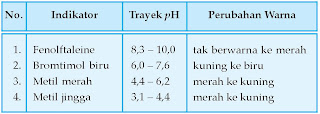 |
| Tabel 1.1. Indikator buatan beserta trayek pH. |
 |
| Contoh pH meter digital. |
Perhatikan gambar pH di samping.
Indikator universal adalah indikator yang terdiri dari berbagai macam indikator yang memiliki warna berbeda untuk setiap nilai pH 1 – 14. Indikator universal ada yang berupa larutan dan ada yang berupa kertas. Indikator universal selalu dilengkapi dengan warna standar untuk pH 1 – 14.
Cara menggunakan indikator universal adalah:
1) Mencelupkan kertas indikator universal dalam larutan yang akan diselidiki pH-nya atau menambahkan
beberapa tetes indikator universal dalam larutan yang diselidiki pH-nya,
2) Mengamati perubahan warna dan membandingkan dengan warna standar.
b. Indikator Alami
Indikator alami yang dapat digunakan untuk menentukan sifat asam, basa, dan garam suatu zat antara lain kulit
manggis, bunga sepatu, dan kubis ungu. Untuk menjadikan indikator alami, maka kulit manggis, bunga sepatu, dan kubis ungu terlebih dahulu dibuat ekstrak dengan cara menghaluskannya dan menambahkan air.
Ekstrak kulit manggis pada keadaan netral berwarna ungu. Jika ekstrak kulit manggis, ditetesi larutan asam, maka warna ungu akan berubah menjadi cokelat kemerahan dan jika ditetesi larutan basa akan berubah menjadi biru kehitaman.
Indikator Asam Basa
Tujuan: Mengidentifikasi asam basa dengan indikator alami dan kertas lakmus.
Alat dan bahan: Wadah kaca, pipet tetes, tabung reaksi dan raknya, aquades, kertas lakmus merah, dan biru, ekstrak kembang sepatu, dan larutan uji yaitu cuka, jus jeruk, larutan garam dapur, larutan pasta gigi, larutan air kapur, larutan H2SO4, dan larutan NaOH.
Prosedur kerja:
1. Siapkan indikator kembang sepatu dengan cara seperti berikut.
a. Potong-potong kembang sepatu.
b. Masukkan potongan-potongan kembang sepatu dalam blender, kemudian tambahkan air.
c. Blender air dan kembang sepatu.
d. Saring dan ambil filtratnya.
e. Amati warna filtrat tersebut.
2. Masukkan masing-masing 2 mL larutan uji ke dalam tabung reaksi yang berbeda. Beri kode A, B, C, D, E, F, G pada masing-masing tabung reaksi larutan uji.
3. Teteskan indikator kembang sepatu pada masing-masing tabung reaksi. Perhatikan gambar di samping.
4. Amati yang terjadi dan perhatikan warna masing-masing larutan.
5. Siapkan kertas lakmus merah dan biru dalam wadah kaca yang berbeda.
6. Teteskan larutan uji dengan menggunakan pipet tetes ke atas kertas lakmus biru dan merah tersebut. Perhatikan gambar di samping. Ulangi langkah-langkah ini untuk masing-masing larutan uji.
7. Amati perubahan warna pada kertas lakmus.
8. Apakah kesimpulan dari percobaan ini?
Sumber: www.indigo.com
Hati-hatilah menggunakan asam sulfat (H2SO4) karena bahan ini berbahaya (korosif)!
2. Mengelompokkan Bahan-Bahan Berdasarkan Konsep Asam, Basa, dan Garam
Definisi asam dan basa menurut Stave Arrhenius, seorang kimiawan Swedia adalah sebagai berikut. Asam adalah suatu zat yang melepaskan ion hidrogen (H+) ketika dilarutkan dalam
air, sedangkan basa adalah zat yang melepaskan ion hidroksida (OH¯). Definisi ini membatasi asam dan basa untuk zat-zat yang dapat larut dalam air.
Contoh reaksi kimianya adalah:
• HCl(aq) → H+(aq) + Cl¯(aq) (asam)
• NaOH( aq) → Na+ (aq) + OH¯ (aq) (basa)
Bahan-bahan di lingkungan sekitar kita dapat dikelompokkan berdasarkan konsep asam, basa, dan garam.
a. Asam
Sebelum kita mempelajari konsep asam, terlebih dahulu kita sedikit belajar mengenai atom. Atom adalah partikel terkecil dari suatu zat yang tidak dapat diuraikan lagi menjadi partikel yang lebih kecil dengan reaksi kimia biasa. Atom terdiri dari tiga jenis partikel subatom yaitu elektron, proton, dan neutron. Penjelasan atom lebih lanjut akan kita pelajari nanti di kelas VIII.
Svante August
Atom hidrogen adalah atom yang paling sederhana karena hanya memiliki satu proton dan satu elektron. Jika kita andaikan atom hidrogen itu kehilangan elektronnya, sehingga tinggal satu proton dengan satu muatan listrik positif, maka atom tersebut sudah tidak netral lagi, tetapi sudah menjadi ion dengan satu muatan positif. Ion adalah atom yang bermuatan listrik. Ion hidrogen ditandai dengan lambang H+. H berarti hidrogen dan tanda (+) berarti ion tersebut bermuatan positif.Svante August Arrhenius (1859- 1927) adalah seorang ilmuwan Swedia yang membantu meletakkan dasar-dasar kimia modern. Beliau lahir di Uppsala, Swedia. Pada tahun 1903 beliau mendapat Penghargaan Nobel dalam Kimia atas karyanya mengenai ionisasi. Arrhenius mengemukakan bahwa senyawa dalam larutan dapat terurai menjadi ion-ionnya, dan kekuatan asam dalam larutan aquades tergantung pada konsentrasi ion-ion hidrogen di dalamnya.
Dengan memahami pengertian ion hidrogen, kamu dapat memahami pengertian asam. Menurut pengertian ini, asam adalah zat apa saja dalam molekulnya mempunyai satu atom hidrogen yang mampu memisahkan diri menjadi ion hidrogen. Dengan kata lain, semua asam adalah sumber ion hidrogen atau proton.
Asam dapat menghantarkan arus listrik karena asam dapat melepaskan ion-ion dalam larutannya. Asam kuat merupakan elektrolit yang baik. Contoh penggunaannya adalah asam sulfat (H2SO4) sebagai elektrolit dalam aki. Dalam kehidupan sehari-hari kamu dapat menemui penggunaan asam secara luas, seperti dalam obat-obatan, pembuatan pupuk, dan sebagai bahan peledak. Meskipun asam merupakan senyawa yang sangat berguna, asam juga dapat mengakibatkan kerusakan karena sifatnya yang korosif. Contohnya adalah hujan asam yang dapat merusakkan bangunan.
Asam dapat dikelompokkan menjadi dua, yaitu asam organik dan asam anorganik. Asam organik merupakan senyawa asam karbon yang dihasilkan tumbuhan dan hewan. Kebanyakan asam ini tidak berbahaya dan banyak memberi aroma pada buah dan makanan. Contoh asam organik antara lain minyak dan lemak yang bersenyawa dengan gliserol, asam metanoat (HCO2H) atau asam formiat dalam lebah penyengat dan beberapa semut yang berfungsi untuk membela diri. Beberapa jenis asam organik
ditunjukkan pada Tabel 1.2.
 |
| Tabel 1.2. Beberapa contoh Asam Organik. |
Asam anorganik merupakan asam yang dibuat dari mineral-mineral dan nonlogam. Asam inilah yang digunakan untuk membuat plastik, serat, pupuk, pewarna, dan bahan kimia lain. Asam anorganik dalam keadaan pekat biasanya korosif, dapat melukai kulit, dan dapat melarutkan logam dengan cepat, bahkan kaca. Misalnya asam fluorida (HF) dapat melarutkan kaca. Namun, ada juga asam anorganik yang tidak berbahaya, misalnya asam borat (H3BO3) yang merupakan bahan baku utama pembuatan salep mata.
Beberapa contoh asam anorganik ditunjukkan pada Tabel 1.3.
 |
| Tabel 1.3. Beberapa jenis asam anorganik. |
Seperti halnya asam, senyawa basa juga akan terionisasi menjadi ion ketika dilarutkan ke dalam air. Seperti yang telah kamu ketahui, basa yang khas adalah larutan alkali, seperti larutan natrium hidroksida (NaOH). Apabila NaOH dilarutkan dalam air maka akan terbentuk ion natrium positif (Na+) dan ion negatif (OH¯) yang disebut hidroksida karena terdiri atas atom hidrogen dan atom oksigen. Ion hidroksida mempunyai satu muatan negatif pada kedua atom tersebut sebagai satu unit. Reaksi ionisasi natrium hidroksida ini dapat dituliskan seperti berikut. NaOH → Na+ + OH¯. Basa meliputi oksida, hidroksida, dan karbonat logam.
Contoh basa ditunjukkan pada Tabel 1.4.
 |
| Tabel 1.4. Beberapa jenis basa dan rumus kimianya. |
Contoh larutan basa yang sering kamu temui adalah aluminium hidroksida Al(OH)3 yang terdapat dalam
deodorant, amoniak (NH3) yang terdapat dalam pembersih debu, dan kalsium hidroksida dalam plester. Obat sakit maag mengandung basa magnesium hidroksida (Mg (OH)2) yang berfungsi mengurangi tingkat keasaman lambung yangterlalu tinggi. Penggunaan basa yang lain adalah penambahan kapur (basa) untuk mengurangi tingkat keasaman tanah gambut agar dapat ditanami.
c. Garam
Bagaimana garam dapat terbentuk? Garam terbentuk ketika suatu asam dan basa bereaksi dan saling menetralkan satu sama lain sehingga hasilnya tidak mempunyai sifat-sifat asam dan basa. Ion hidrogen (H+) dari asam dan ion hidroksida (OH-).
dari basa dalam reaksinya satu sama lain akan membentuk air. Perhatikan bentuk persamaannya berikut ini.
H+ + OH¯ → H2O
Contoh garam yang paling sering kita temukan adalah NaCl atau garam dapur. Natrium klorida (NaCl) terjadi karena reaksi antara natrium hiroksida (NaOH) dengan asam klorida (HCl) dengan reaksi seperti berikut.
NaOH + HCl → NaCl + H2O
Jika airnya diuapkan maka akan kita dapatkan garam NaCl atau garam dapur yang berupa padatan berwarna putih. Jika garam dapur tersebut kamu larutkan ke dalam air, maka akan terbentuk ion natrium (Na+) dan ion klorida (Cl-), dengan reaksi yaitu: NaCl → Na+ + Cl¯.
Beberapa contoh garam ditunjukkan pada Tabel 1.5.
 |
| Tabel 1.5. Beberapa jenis garam, rumus kimianya, serta kegunaannya. |
3. Skala Keasaman dan Kebasaan
Seperti yang telah kamu pelajari di depan bahwa untuk mengidentifikasi asam, basa atau garam dapat digunakan indikator (indikator alami dan indikator buatan). Adapun untuk mengetahui tingkat keasaman dan kebasaan suatu senyawa dapat diketahui dari nilai pH (power of hydrogen).
 | ||
| Skala pH dan warna yang ditunjukkan oleh kertas indikator. Bandingkan warna pada kertas indikator dengan warna standar pada wadah untuk mengetahui pH larutan. |
Derajat keasaman suatu senyawa berbeda-beda. Ada yang bersifat asam kuat dan ada pula yang bersifat asam lemah. Semakin kecil nilai pH atau semakin mendekati skala nol, maka
tingkat keasamannya semakin kuat. Sebaliknya, jika nilai pH semakin besar atau mendekati skala 7, maka tingkat keasamannya semakin lemah. Contoh, jika asam cuka (CH3COOH) mempunyai pH = 3 dan jus jeruk mempunyai pH = 4 maka asam cuka mempunyai keasaman yang lebih kuat daripada jus jeruk.
Begitu juga dengan basa, semakin besar nilai pH atau semakin mendekati nilai 14 maka tingkat kebasaannya semakin kuat. Sebaliknya, jika nilai pH semakin kecil atau semakin mendekati nilai 7 maka tingkat kebasaannya semakin lemah. Contoh, jika natrium hidroksida (NaOH) mempunyai nilai pH = 13, sedangkan pasta gigi mempunyai pH = 8 maka natrium hidroksida (NaOH) mempunyai kebasaan yang lebih kuat
daripada pasta gigi.



 Print Halaman Ini
Print Halaman Ini
0 komentar:
Posting Komentar